Soal-soal Reaksi Reduksi Oksidasi (Redoks) dan Pembahasan. Pada postingan sebelumnya telah di posting artikel mengenai materi Kimia Reaksi Reduksi Oksidasi (Redoks). Untuk saat ini agar adik-adik lebih memahami tentang Reaksi Reduksi Oksidasi ini, maka admin kembali memberikan beberapa Contoh soal Reaksi Reduksi Oksidasi.Semoga bermanfaat :).
Tentukan bilangan oksidasi atom dari zat/spesi di bawah ini!
a. Fe2O3
b. Cu(NO3)2
c. S2O32-
d. Cr2O72-
Pembahasan:
a. Fe2O3 : Bilangan oksidasi senyawa netral = 0
a. Fe2O3 : Bilangan oksidasi senyawa netral = 0
bilangan oksidasi (b.o.) atom O = -2
( 2 x b.o. Fe ) + ( 3 x b.o. O ) = 0
( 2 x b.o. Fe ) + ( 3 x -2 ) = 0
( 2 x b.o. Fe ) = +6
( b.o. Fe ) = +3
b. Cu(NO3)2 : terdiri atas ion Cu2+dan 2 ion NO3-. Biloks ion mono atomik = muatannya. Muatan ion Cu2+ adalah 2+ jadi biloks Cu dalam senyawa ini = +2
Untuk ion NO3-
Jumlah total biloks = -1
bilangan oksidasi (b.o.) atom O = -2
( b.o. N ) + ( 3 x b.o. O ) = -1
( b.o. N ) + ( 3 x -2 ) = -1
( b.o. N ) = +5
c. S2O32- : jumlah total biloks = -2
bilangan oksidasi (b.o.) atom O = -2
( 2 x b.o. S ) + ( 3 x b.o. O ) = -2
( 2 x b.o. S ) + ( 3 x -2 ) = -2
( b.o. S ) = +2
d. Cr2O72- : jumlah total biloks = -2
bilangan oksidasi (b.o.) atom O = -2
( 2 x b.o. Cr ) + ( 7 x b.o. O ) = -2
( 2 x b.o. Cr ) + ( 7 x -2 ) = -2
( b.o. Cr ) = +6
Periksalah apakah reaksi berikut tegolong reaksi redoks atau bukan redoks!
a. 2K2CrO4(aq) + H2SO4(aq) " K2SO4(aq) + K2Cr2O7(aq) +H2O(l)
b. 2FeCl3(aq) + H2S(g) " 2FeCl2 (aq) + 2HCl(aq) + S(s)
Pembahasan:
Analisis masalah :
Beberapa tips untuk menbantu menyelesaikan soal di atas :
- Reaksi yang melibatkan unsur bebas umumnya tergolong reaksi redoks.
- Atom unsur yang perlu diperiksa adalah atom unsur yang dalam reaksi berganti tipe rumusnya.
Misalnya,
H2SO4" K2SO4 : atom S tidak perlu diperiksa, sebab tetap sebagai ion SO42-
FeCl3 " FeCl2 : atom Fe perlu diperiksa, sebab berganti tipe rumusnya.
- Koefisien reaksi tidak mempengaruhi bilangan oksidasi.a. 2K2CrO4(aq) + H2SO4(aq) " K2SO4(aq) + K2Cr2O7(aq) +H2O(l)
+1 +6 -2 +6
Atom H,S,O dan K tidak perlu diperiksa karena tidak berganti tipe rumus. Atom Cr perlu diperiksa, karena berganti tipe rumusnya. Dari persamaan tersebut ternyata atom Cr tidak mengalami perubahan biloks, demikian juga dengan atom yang lain. Jadi, reaksi ini bukan reaksi redoks.
a. 2FeCl3(aq) + H2S(g) " 2FeCl2 (aq) + 2HCl(aq) + S(s)
+3 -2 +2 0
Atom Fe dan S perlu diperiksa biloksnya karena mengalami perubahan tipe rumus. Biloks Fe berubah dari +3 menjadi +2 artinya Fe mengalami reduksi. Biloks S berubah dari -2 menjadi 0, artinya S mengalami oksidasi. Jadi, reaksi ini tergolong reaksi redoks.
Contoh soal 3
Tentukan reduktor, oksidator, hasil reduksi dan hasil oksidasi dalam reaksi berikut ini!
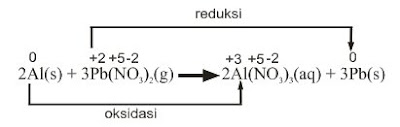
2Al(s) + 3Pb(NO3)2(g) à 2Al(NO3)3(aq) + 3Pb(s)
Bilangan oksidasi Al berubah dari 0 menjadi +3 dan Pb dari +2 menjadi 0. Maka,Oksidator : Pb(NO3)2
Reduktor : Al
Hasil oksidasi : Al(NO3)3
Hasil reduksi : Pb
0 Response to "Soal Reaksi Reduksi Oksidasi (Redoks) dan Pembahasan"
Posting Komentar